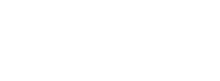vol.10
産学官連携コンソーシアムと「富岳」で築く
インシリコ創薬の先進的基盤

産学官の有志が集まり2014年末に結成された「FMO創薬コンソーシアム」。現在は、約140人のメンバーが全国各地からスーパーコンピュータ「富岳」にアクセスし、計算を行っています。「富岳」では多数の計算ノードを長時間使う大規模な計算が行われる一方、大勢がノードを少しずつ使うという使い方も可能です。FMO創薬コンソーシアムの目的は、FMO法を創薬(新薬の開発)に使える実用的な手法として発展させること。そのために、基礎的なデータを蓄積し、公開するとともに、よりよいデータを生み出すための新しい手法を次々に開発しています。代表を務める福澤さんに、これまでの成果と今後の展開を聞きました。

薬の論理的な設計に役立つFMO法
現在、多くの新薬が、病気の原因となるタンパク質を標的として開発されています。新薬開発には複数の段階があります。まず、標的タンパク質に結合してその機能を阻害(または増強)する候補化合物を見つけなければなりません。そして、候補化合物が見つかった後は、その化合物の構造を少しずつ変えて薬効や安全性を高めていくことが必要です。これらの段階では、候補化合物を実際に合成して実験する必要があるため、一つの新薬が市場に出るまでに合成される化合物の数は数万にも及び、新薬開発の期間とコストを押し上げる要因の一つとなっています。
そのため、コンピュータを使って、化合物が標的タンパク質とどのように結合しているかを計算し、その結果をもとに候補化合物を設計する「インシリコ創薬」がさかんになっています。「インシリコ創薬は実験を減らせるので効率的ですし、まだ合成されていない化合物の可能性も調べられるというメリットがあります」と福澤さんは説明します。
タンパク質-化合物複合体の結合状態を計算する方法はいくつかありますが、福澤さんたちが使っているのは、1999年に大阪府立大学の北浦和夫教授(現 大阪大学招へい教授)が開発した「フラグメント分子軌道(FMO)法」です(図1)。「私たちは、複合体の状態を正確に把握したいと考えています。そのためには、量子化学計算を行って電子状態を明らかにする必要がありますが、タンパク質のような巨大な分子では計算量が膨大になってしまいます。FMO法は、この問題を克服するために考えられた方法なのです」。
FMO法では、巨大分子を小さなフラグメントに分割し、フラグメントやフラグメントペアごとに量子化学計算を行ってから全体を再構築することで、タンパク質全体の電子状態を計算します。フラグメントごとの計算の際に、周囲のフラグメントの影響をうまく採り入れることで、精密な電子状態計算を効率的に行うことができます。
「さらに重要なのは、FMO法では、タンパク質と化合物の間のさまざまな相互作用を定量的に把握できることです。相互作用がきちんと分かると、候補化合物を論理的に設計できます。このため、はっきり公表されることは少ないのですが、製薬企業の創薬の現場でもFMO法が使われることが増えているようです」と、福澤さんはFMO法を用いる意義を語ります。
図1
フラグメント分子軌道(FMO)法と構造ベース創薬
(a)FMO法では、巨大分子を小さなフラグメントに分割して、フラグメントごとに量子化学計算を行ってから全体を足し合わせる。タンパク質は丸で囲んだようにアミノ酸単位に分割する。タンパク質に結合する化合物は一つのフラグメントとして扱うことが多いが、機能部位ごとに分割することもできる。
(b)インフルエンザの治療に使われるタミフル®(一般名:オセルタミビル)は、インフルエンザウイルスの増殖に必要なノイラミニダーゼという酵素の活性部位に結合し、その働きを抑える。タミフル®は、様々な相互作用(正電荷と負電荷が引き合う静電相互作用や水素結合など)によって活性部位に結合するように設計されている(これを「構造ベース創薬」という)。FMO法を構造ベース創薬に適用すると、薬の候補化合物がタンパク質のどのフラグメントとどのくらいの強さで相互作用をしているかを精密に知ることができ、標的タンパク質と適切な箇所でより強く相互作用する候補化合物を選び出すことができる。
大規模な計算資源を使い、着々とデータを蓄積
「ただし、いくらFMO法が優れていても、アカデミアや製薬会社の研究者が個別に計算に取り組んでいるだけでは実用的な創薬手法には育ちません。産学官連携で大規模計算資源を使わせていただき、データベースや方法論を整備して普及させる必要があると考えました」という福澤さん。FMO法のプロジェクトをスーパーコンピュータ「京」の課題に申請するために、2014年末に産学官の研究者に呼びかけてコンソーシアムを立ち上げました。「ちょうどHPCIのネットワーク利用が始まった頃でしたので、その仕組みを通じてメンバーが日本全国から『京』にアクセスし、同じ環境で同じクオリティの計算を行うことができました。そのおかげでコンソーシアムの基盤を確立できたと思います」と福澤さんは振り返ります。
コンソーシアムでは、酵素や受容体など創薬の標的となる可能性が高いタンパク質を主な対象とし、タンパク質-化合物複合体の結合状態を次々に計算していきました。そして、「FMOデータベース」を構築し、2019年2月にはそれまでに計算したデータを、誰もが利用できるように一般公開しました。その後もデータはどんどん追加され、2022年10月14日時点で公開データ1万5653件、非公開データを含めると1万7625件に上っています。
より現実に近いデータを得るために、ゆらぎを採り入れた手法を開発
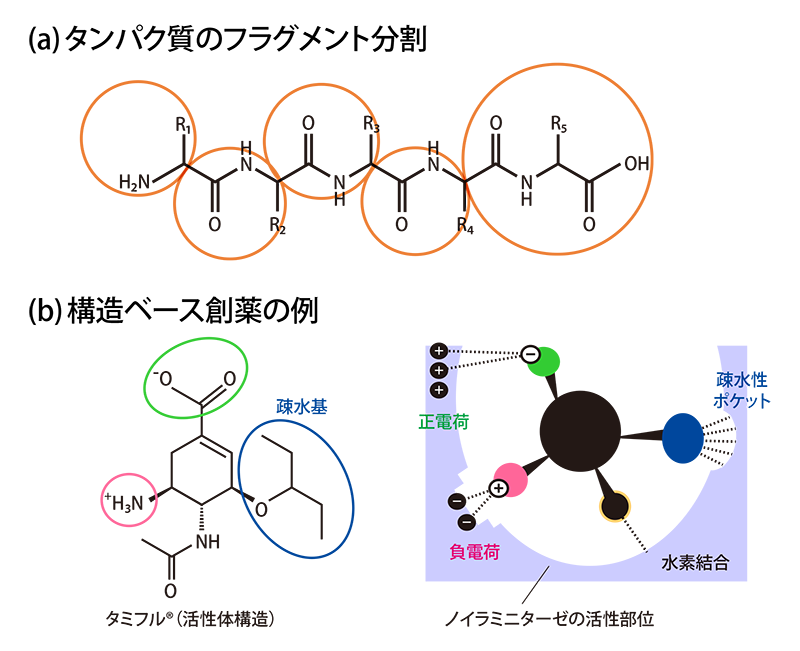
福澤さんたちは、データの蓄積だけでなく新たな手法の開発にも取り組みました。その背景には、「生体内ではタンパク質などの分子の構造はいつもゆらいでいるが、FMO法では一つの“止まった”構造について計算しているので、生体内でのダイナミックな相互作用は分からない」という問題意識がありました。タンパク質のゆらぎを採り入れるために福澤さんたちが考えたのは、分子の動きをシミュレーションする「分子動力学(MD)法」とFMO法を融合することでした(図2)。まずMD法でタンパク質-化合物複合体がゆらぐ「動画」をつくり、そこから一定の時間間隔で「スナップショット」を取得します。次に、その1枚1枚の構造についてFMO計算を行い、最後にそれらの結果を平均化するのです。この手法により、分子のゆらぎがある場合の相互作用を明らかにしようというわけです。
「2017年ごろから『京』でこの計算に着手しました。MD法については京都大学の奥野恭史先生が代表のコンソーシアム(KBDD)のご協力もいただいたのですが、私たちが不慣れなこともあって計算はなかなかうまくいかず、『京』の運用終了後にHPCIの計算資源であるTSUBAME3.0やOakforest-PACSも使わせていただいて、ようやく計算をやり遂げることができました」。このときに苦労して確立した手法は今、「富岳」で力を発揮しています。新型コロナウイルス感染症の治療薬の作用(図2参照)を詳細に解明したのをはじめ、重要な創薬ターゲットである膜タンパク質や、新たなタイプの薬として期待される核酸医薬※1の研究もこの手法で行っています。
「『富岳』でも、『京』のときと同様に全国からメンバーがアクセスして計算を行っています。『富岳』の計算パワーは圧倒的で、『京』の100倍ぐらいになったと実感しています。MD法で取得した100個の構造のFMO計算を行うのに、1ラックを使えば30時間ほどですみ、そこからすぐに、計算のクオリティをさらに上げるための科学的な議論に入れます」と、福澤さん。今後は、MD法とFMO法の融合手法を若手の研究者に広め、さまざまな複合体に適用していく考えです。
図2
分子動力学(MD)法とFMO法の融合による動的な相互作用の解析
MD法は、原子が互いに力を及ぼしながら運動する様子をシミュレーションする手法。まず、MD法で複合体のゆらぎを動画化し、一定間隔で複合体の構造を取り出してFMO計算を行う。実際には、100個程度の構造を取り出す。それらのFMO計算の結果を平均化することで、タンパク質のゆらぎを採り入れた動的な相互作用が明らかになる。これにより、より現実に近い環境での薬の設計が可能になると期待される。ここに示したのは、新型コロナウイルス感染症治療薬のレムデシビルと、ウイルスのRNA依存性RNAポリメラーゼ、RNAの複合体について実際にMD法で作成した動画からのスナップショットで、構造は少しずつ異なる。
量子化学計算で生命現象を解明したい
一方で、福澤さんたちは、これまでに蓄積した膨大なデータの活用にも取り組んでいます。その一つの例は、機械学習による相互作用の強さの予測です。「フラグメント間の相互作用には、正電荷と負電荷が引き合う静電相互作用や水素結合など、いくつかの種類があります(図1b)。その種類ごとにデータを学習すると、フラグメント間の距離がこのぐらいのときに、このぐらいの強さの相互作用が発生するということがわかってきます。こうした情報を蓄積することで、FMO計算を行わなくても相互作用の強さを予測できるようにしたいと考えています」と、福澤さんは説明します。
このように、FMO創薬コンソーシアムは、インシリコ創薬の基盤となるFMO計算のデータを蓄積するとともに、新たな手法の開発に取り組み、多くの成果をあげてきました。しかし、福澤さんはそのずっと先に、量子化学計算の専門家としての大きな夢を抱いています。「量子化学計算は仮定や経験的パラメータなどを使わない第一原理計算ですから、正しい計算さえできれば正しい結果が得られます。私はその量子化学計算であらゆる生命現象を解明したいのです」。この夢の実現に向けて、福澤さんは、より精度の高いゆらぎの計算、金属を含むタンパク質や酵素反応のFMO計算、RNAの動力学など、「富岳」の次、さらにその次のスパコンで達成すべき目標を設定し、一歩ずつ研究を進めていこうとしているのです。
研究者紹介

福澤さんは「研究のために他の全てをなげうつのではなく、人として充実した生活を送ることが大切」というスタンスをとっています。実際に、料理が好きでミシュランの星をもつ和食の料理人に料理を習ったこともあれば、芸術家と交流することもあるそうです。そうした「科学者以外の人たち」と接する中で、例えば、「料理は厳密にレシピ通りに作るよりも、行間の流れを五感で捉えればよい」といった学びがあったり、「研究も楽曲演奏も、先人が残したものの解釈から始まり、深めていく」といった気づきがあったりするといいます。やりたい研究ができるポストを求めた結果、現在は大阪に単身赴任中ですが、「東京に残してきた中2と小6の子供たちが心配で、なるべく週末は帰るようにしています」と母親の顔も見せる福澤さん。多面的な魅力が人を引き付け、コンソーシアムをまとめ上げる原動力になっているようです。
研究課題名:
HPCIを活用したFMO創薬プラットフォームの構築
(hp190133/ hp200101/ hp210130/ hp220143)
課題代表者:大阪大学大学院薬学研究科 福澤 薫
(2022年4月より現所属、3月までは星薬科大学薬学部)
好きと嫌いと得意と苦手

もともと数学が大好きな少年でしたが、高校生の頃には物理学にも興味津々でした。多分その頃出会った物理の先生がとても魅力的な方だったからだと思います。そういうわけで大学入学後はなんとなく「数理物理学の研究ができるところに行きたいな」と思っていたのですが、大学一年生の頃に経験した震災の影響で地球物理学を志すようになりました。
地球物理学では複雑系を扱うことが多いため数値シミュレーションが力を発揮する場面が多々あります。プログラミング能力は地球物理学における必須テクというわけです。このため私が在籍した地球惑星物理学科では学部三年生向けに重点的にプログラミングの講義を行うわけですが、これが(パソコン初心者には)あまりに難しかった。すっかり「自分には数値シミュレーションの才能はないのか」と思い込んでしまい、その後も何やら難しそうな物理の理論や数学の勉強ばかりしていました。余談ですが今ではそのプログラミングの授業を担当する立場になってしまったわけですから人生わからないものです。
そんな「数値シミュレーションが嫌いな」若者も、シミュレーション研究をゴリゴリと推し進める研究室に配属されてしまっては逃げるわけには行きません。苦手意識を克服すべく修士課程の頃はひたすら数値計算の基礎の勉強に明け暮れたわけですが、これが結構面白いわけです。どんな問題にも対応可能な万能のプログラムは存在せず、人が問題に応じて最適なプログラムを設計、実装する必要がある。その真髄に触れて以来、数値シミュレーションは僕の大好物になってしまいました。気づけば博士三年の頃には世界でも類を見ない太陽風シミュレーションを達成するに至りました。
こうして振り返ると、高校時代に出会った教員に影響され物理を志し、大学院の指導教員に影響され数値シミュレーションを習得し、人生の節目には常に人との出会いがあったように思います。今後は何が自分の人生を変えるのか、楽しみにしながら研究に邁進していきたいと思います。
次回は私の同期であり、数値シミュレーションを用いた惑星・衛星研究に取り組んでいる東京工業大学地球生命研究所の杉浦圭佑研究員につなぎたいと思います。
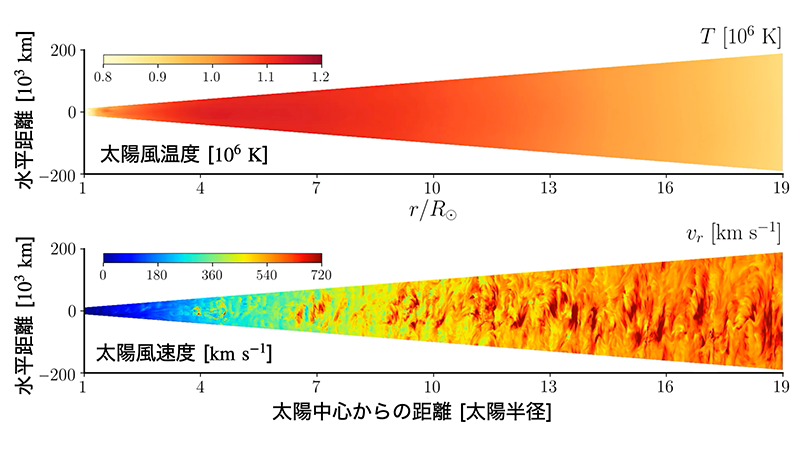
太陽風の三次元シミュレーション結果。二次元平面上での温度分布(上)と速度分布(下)のスナップショットを表示。太陽から離れるにつれ、太陽風が徐々に加速される様子が再現。